本产品是大肠杆菌重组表达来源的噬菌体T7 RNA聚合酶,以含有T7启动子序列(5’-TAATACGACT CACTATAG*-3’)的双链DNA为模板,以NTP为底物,合成与启动子下游的反向单链DNA互补的RNA。双链线性平末端或5’突出末端DNA均可作为T7 RNA聚合酶的底物模板,因此线性质粒、PCR产物均可用作体外合成RNA的模板。
注:G*为RNA转录的第一个碱基
本产品按照GMP规定生产,以液体形式提供,酶活浓度为50 U/μL。
极高的产量:1ug DNA 模板可产生100-200 µg
通用:适用于20nt-10000nt RNA的转录
高的性能:降低IVT过程中的副产物
检测无内切酶、外切酶、RNases
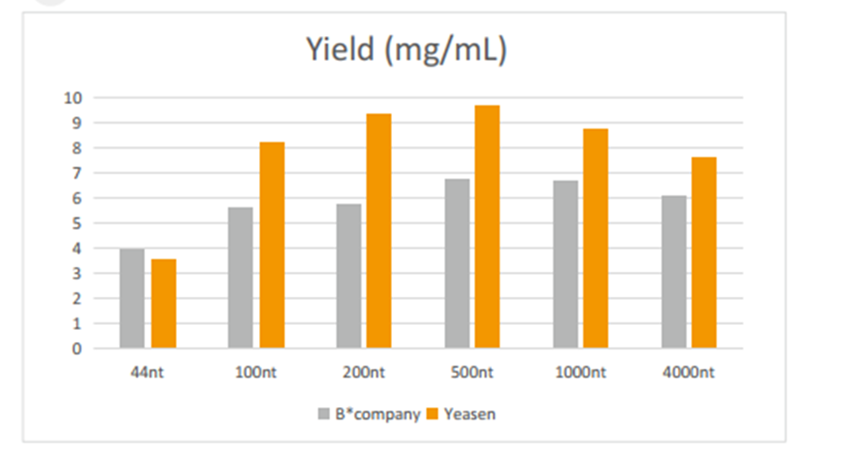
图1:不同片段长度的IVT 产量
不同片段长度的DNA ,在PCR仪上37℃孵育2h,然后用磁珠(Cat#12602)纯化。产量结果用NanoDrop分光光度计测定。
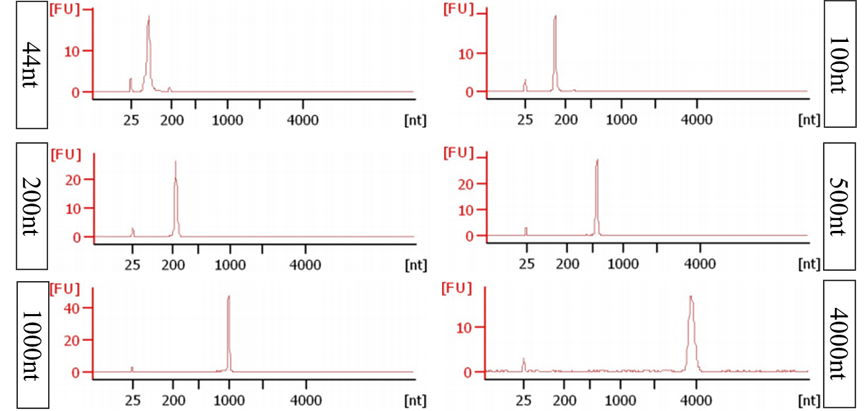
图2:转录得到的不同长度RNA用毛细管电泳图检测
44-4k nt RNA经Agilent检测,结果显示,电泳条带单一;峰型明显、锐利。

图3:不同Cap analog添加量下个指标的数值;
在如下反应条件进行测试:20ul,T7(250U),NTP(10mM) ,37C 3h, LiCl沉淀;结果显示2.5mM及以上帽子添加量,综合性能相对比较好。
-25 ~ -15℃储存,有效期1年。
Q: T7酶的保真性能怎么样?有没有开展相关测试?
A: 我们的T7酶测试了相对保真度,与Thermo的保真度差不多,大概万分之四的突变率。目前野生型的T7保真度都差不多,基本能满足客户的需求。现项目中没有更高保真度T7的开发计划。
Q: 使用T7聚合酶的产量是使用LiCl纯化后进行测定的吗?有没有A260/280和A260/230的数据?
A: 是通过LiCl纯化后进行测定的,我们有记录过相关数据A260/280大概比值再在2.0-2.1之间;使用我们的羧基磁珠纯化也基本在这个范围以内。具体数据可以整理之后再分享。
Q: 采用T7聚合酶转录的时候,有没有什么办法,减少polyA尾多转录的问题?
A: 这一情况是T7反应体系的自身特性,无法完全避免。根据相关的文献,控制mRNA自延长的思路主要还是两方面:
①对模板3'末端上游序列进行优化;
②控制IVT产量,高产量下自我延伸的几率会更高